Yu J, Liu Y, Yin H, Chang Z.
Cell Discov. 2019 Jan 22;5:8.
doi: 10.1038/s41421-019-0080-3. PMID: 30675381; PMCID: PMC6341109.
遺伝的に均質な細菌集団の中で、一部の細胞が休眠状態、非増殖状態(正確には低代謝活性)に入ることはよく知られている。この状態は、実験室、臨床、環境の微生物学において、胞子形成、潜伏、再増殖遅延、パーシスター、あるいは生存しているが培養不可能な状態と呼ばれてきた。このような細菌細胞の状態は100年以上前から認識されていたが、細菌細胞がどのようにしてこのようなユニークな状態に入り、維持し、脱するのかなど、その特性については不明な点が多く残されている。
再増殖ラグ現象は、細菌の培養が可能になるとすぐ、1895年にマックス・ミュラーによって認識されていたが、細菌の増殖サイクルの中で最も理解されていない段階である。関連する現象として、細菌の休眠状態は、ある種の細菌細胞が長期間にわたって再増殖遅延を示す状態であると定義された。その後、活発に分裂している細胞を殺すのに十分な濃度の抗生物質を投与しても死なない、極めて少数の休眠中の非分裂性細菌細胞を指す言葉として、persisterという言葉が生まれた。パーシスターは、治療後の細菌感染症の再発に関与していると推定されている。パーシスターは、親細胞と同じように抗生物質に感受性のある子細胞を作り出すため、抗生物質に耐性がないことが強調されていた。さらに最近では、自然環境中の細菌細胞は、生存しているが培養できない休眠状態にあることが一般的であることが明らかになった。
パーシスターは、遺伝しないこと、存在量が少ないこと、代謝活性を持たないこと、不均一性が高いことなど、その特性はまだよくわかっていない。パーシスターの形成につながる分子メカニズムを理解するために多くの努力がなされており、Hipのような特定のタンパク質やpppGppのような低分子がこのプロセスに重要であると主張されてきたが、現在までのところ多くのことはわかっていない。研究が遅々として進まないのは、細菌のこのような状態を明確に識別することが技術的に非常に困難であることに起因していると思われる。これまでパーシスターは、増殖しないことや多剤耐性があることなどでしか認識されていなかった。特にパーシスターは、従来、細胞サンプルを高濃度の抗生物質で処理した後、コロニー形成単位(colony-forming unit: CFU)の数を間接的に測定することで検出されていた。また、マイクロ流体デバイスを用いてモニターした場合、抗生物質の存在下では増殖せず、抗生物質を除去すると再増殖する細胞として検出されていた。
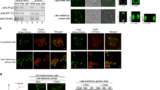
私たちは、遺伝的に導入された非天然アミノ酸を媒介とするタンパク質の光架橋分析を行うことで、生きた細菌細胞内に存在するタンパク質の探索を試みてきた。最近の研究では、FtsZタンパク質の組み立てパターンを調べた。FtsZタンパク質は、細菌細胞質分裂プロセスや、ミトコンドリアや葉緑体が2つに分裂する際に、Zリング構造に集まって必須の役割を果たしている。特に、生きている細菌の細胞内でFtsZがダイナミックなZリング構造に集合するために不可欠な、これまで報告されていなかったFtsZプロトフィラメント間の横方向の相互作用を明らかにした。
この研究の副産物として、私たちは偶然、新しい可逆的な細胞内構造の存在を明らかにし、これを「再増殖遅延体」と名付けた。この構造は、後期定常期の細菌細胞に形成され、細胞の増殖に不可欠な複数のタンパク質を封じ込めている。驚くべきことに、再増殖遅延体は、細菌細胞が再増殖ラグを脱して増殖を再開すると溶解し、同時に封じ込められていたタンパク質を放出して再機能させることができる。また、大腸菌だけでなく、2つの病原菌においても、再増殖遅延体の形成度が高いほど、再増殖遅延の期間が長くなり、抗生物質耐性も高くなることが示された。したがって、再増殖遅延体は、休眠状態のpersister細胞と、活発に増殖している非persister細胞を区別するためのユニークで価値の高いバイオマーカーとして機能するだけでなく、細菌細胞が再増殖ラグから抜け出すための動的な生物学的タイマーとしても機能する。今回の研究では、各パーシスターが特定の深さの持続性を示すことも示されており、このことが、長年にわたって観察されてきたパーシスター亜集団の不均一な性質を説明しているように思われる。本研究で得られた知見は、あらゆる細胞集団におけるパーシスターを特異的に同定・探索するためだけでなく、手強い多剤耐性の病原性パーシスターを根絶するための実行可能な戦略を立案するためにも、大いに役立つはずである。


コメント