Wang M, Nie Y, Wu XL.
ISME J. 2020 Oct 9.
doi: 10.1038/s41396-020-00800-1. PMID: 33037324.
微生物は大規模な群集の中で生活しており、資源の不足や環境刺激に常にさらされている。この苦境を乗り越えるために、微生物は主に代謝分泌と交換を介して、近辺の微生物との複雑な生態学的相互作用のネットワークを形成している。例えば、プロテアーゼ、ヒドロラーゼ、クオラムセンシングシグナル分子は、様々な分泌系を介して分泌され、微生物が栄養分を獲得したり、群集構造を調節したりするのを助けている。膜小胞(MV)は、微生物の細胞膜から規則的に放出されるナノサイズの球状の芽であり、タイプゼロ分泌系として近年同定されている。MVは多分子複合体を充填し、長距離輸送するのに適しており、ストレス応答、栄養獲得、宿主の生存、微生物の相互作用に重要な役割を果たしている。MVに充填される物質は、その起源によって決定される。MVは、グラム陰性菌では外膜小胞(OMV)のように細菌細胞の外膜から放出され、グラム陽性菌では細胞質膜から放出される。典型的には、OMVでは外膜タンパク質が主な内容物であるが、MVでは細胞質膜タンパク質と細胞質タンパク質が主な内容物である。
MV中の化合物は生産細胞の組成を反映しており、化合物組成の変化によりMVの機能を変化させることができる。例えば、エンベロープストレス下の大腸菌由来のMVには、複数のミスフォールドされたタンパク質が含まれており、その放出により細菌の生存率を高められる。Fibrobacter succinogenesは、主に不溶性セルロースを消化するために糖質関連酵素を充填したMVを放出する一方、Moraxella catarrhalisは宿主の免疫抑制に関与するUspA1/A2病原性因子を充填したMVを放出する。さらに、MVは細胞間のコミュニケーションにも利用されており、標的細胞との融合によってそれが達成されている。例えば、DNAを担持したMVは、遺伝子水平伝搬に関与している。また、MVはその脂質性のため、細胞間の疎水性シグナル分子の送達に非常に適しており、例えば、クオラムセンシング化合物ホモセリンラクトンのように、細胞間でのシグナル分子の送達にも適している。
前述の機能研究は主にグラム陰性菌のOMVを中心に行われてきたが、グラム陽性菌のMVの機能はあまり研究されておらず、病原体やマイコバクテリアの研究に限られていた。最近、Mycobacterium tuberculosisやCorynebacterium glutamicumなどの特定のグラム陽性細菌は、ペプチドグリカン層に共有結合したアラビノガラクタン層と、ミコール酸からなる特殊な外膜(マイコメンブレン)からなる新規な細胞壁構造を有していることが発見された。これらのマイコメンブレインを含むグラム陽性菌が、この特殊な外膜から多様な機能を持つMVを放出しているかどうかは不明のままである。
鉄は酸化還元反応や電子移動に関与するため、生命に必須の元素である。鉄は生理的pH(Ksp = 10-58)ではほとんど不溶であり、その結果、細菌が十分な量の分子鉄を取得することは非常に困難である。鉄が制限された環境下で鉄イオンを獲得するために、細菌はシデロフォアと呼ばれる低分子鉄キレート剤を分泌している。また、病原性微生物と環境微生物の両方にとって重要な鉄源はヘムである。病原性微生物の主なヘム源は宿主のヘモグロビンとアルブミンである。自然環境では、ヘムタンパク質は微生物に広く分布し、利用されている。例えば、ヘムは、呼吸、光合成、アンモニア同化、窒素固定に関与する酸化還元酵素の重要な補酵素群である。さらに、ヘムタンパク質は微生物のバイオフィルムに広く存在している。別の研究では、ナノモル当量の鉄(III)プロトフォリンIX様化合物が天然の河口水や河川で発見されたと報告している。
ヘムを同化するために、細菌は細胞表面のヘム結合タンパク質、および細胞外でヘムを結合する少数のヘモフォアを利用する。緑膿菌やインフルエンザ菌などのグラム陰性細菌は、いくつかの外膜受容体、細胞膜周囲TonB複合体、細胞膜内のABCトランスポーターからなる保存されたヘム獲得システムを持っている。ヘムの認識および結合は、グラム陽性細菌の細胞表面上のSortase結合タンパク質、例えば黄色ブドウ球菌のIsdHおよびBacillus anthracisのIsdX1/2によって行われる。これらのタンパク質は、ヘム結合に関与するNEAT(near transporter)ドメインを含む。Corynebacterium diphtheriaeは、HtaABとHmuTUVからなるヘム輸送のためのユニークなシステムを利用している。細胞表面に露出したヘム結合タンパク質HtaAとHtaBは、細胞膜に固定するリポタンパク質である。それらのヘム結合機構は、NEAT結合ドメインとは独立している。HtaAは、遊離ヘム分子とヘモグロビンからのヘムの両方を捕捉する。その後ヘムはHtaAからHtaBへと移動し、さらにABCトランスポーターHmuTUVへと移動した後、細胞質内のヘムオキシゲナーゼによって分解される。
ヘム同化に関与する経路が同定されているが、それらはほとんどがヘム-細胞またはヘムタンパク質-細胞接触依存性である。自然環境ではヘムまたはヘムタンパク質の濃度が非常に低いため、ヘムと細胞の直接の接触の可能性は低いと考えられる。また、ヘムを獲得するためにヘモフォアを分泌する種は限られており、これは一般的な経路ではない。細菌が広い範囲で普遍的にヘムを獲得するかどうかは不明である。
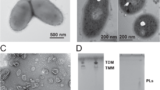
Dietzia sp.はCorynebacterialesに属する高G + C含有グラム陽性菌である。その特徴の一つは、ミコール酸を含むマイコメンブレインが存在することである。Dietzia sp.は韓国の塩漬け食品、東アフリカのソーダ湖、エジプトの砂漠、高原永久凍土地域など様々な極限環境から分離されている。Dietzia sp. DQ12-45-1bは、もともと鉄源が非常に限られている油井液から分離されたものであった。ここでは、DQ12-45-1bのマイコメンブレイン由来MVの構造と、細胞外ヘムのリサイクルと共有に果たす役割を調べた。その結果、DQ12-45-1bが細胞外ヘムを放出することを明らかにした。MVのプロテオームを鉄制限条件下と鉄過剰条件下で比較したところ、鉄制限条件下ではヘム結合タンパク質が濃縮されていることが明らかになった。MVが細胞外ヘム捕捉・輸送、特に環境ヘムタンパク質からのヘムリサイクルに関与していることを明らかにした。MVが運ぶヘムが複数の種で利用されていることを明らかにし、さらに、膜融合効率と種の進化距離がヘム輸送を決定することを検証した。これらの結果は、MVが細胞外ヘムをリサイクルすることを明確に示しており、多様な微生物群集においてMVがヘムの共有に重要な役割を果たしていることを示唆している。


コメント