Sánchez-Navarrete J, Ruiz-Pérez NJ, Guerra-Trejo A, Toscano-Garibay JD.
Sci Rep. 2020 Jul 9;10(1):11240.
doi: 10.1038/s41598-020-67838-1. PMID: 32647236; PMCID: PMC7347587.
私たちの惑星の主なエネルギー源は太陽である。その中心部で起こる核融合は、Critchfield’s cycleと呼ばれる固定されたプロトン-プロトン連鎖反応に従うもので、最終的には広い電磁スペクトル([p+ + p+ → H2 + e+ + Ʋe, H2 + p+ → He3 + gamma, visible or UV];[He3 + He3 → He4 + p+ + p+])を生じる。
紫外線は、電離放射線のすぐ下に分類される高エネルギー波長で構成されたスペクトルの一部である。主にA型(UV-A)(315-400nm)、B型(UV-B)(280-315nm)、C型(UV-C)(200-280nm)の3つの領域がある。UV-Cの光は、エネルギーが最も高く生物にとって危険であるが、そのほとんどは宇宙線、ガンマ線、X線などの他の放射線と一緒に成層圏のオゾン層によって保持され、通常は表面に到達していない。地球に降り注ぐ太陽からの光は、可視光(62.7%)、赤外線(31.9%)、UV-A(5.1%)、UV-B(0.3%)で構成されている。日光暴露中の生物学的損傷はUV-Bによって引き起こされており、地球上の主な変異原性の物理的なエージェントと考えられている。
1970年代以降、NASAはオゾン層の厚さの変化を監視しており、特に南極では徐々にではあるが劣化が見られ、両半球ではオゾン層破壊イベント(ミニホール)の頻度が上昇している。この現象は、放射線に対するオゾン層の保護能力を阻害し、その結果、高エネルギーの紫外線を浴びる確率を高めており、これはヒトにおける癌関連の突然変異の発生に寄与する重要な要因であるかもしれない(photocarcinogenesis)。
紫外線の生物学的影響を記述し、予測するために、複数の実験デザインが利用可能である。より簡単な実験システムとしては、細胞培養に用いる人工光源の使用や、生存・死亡動態の数学的モデル化などがある。
最も安価で広く流通している人工紫外線光源は、タングステン電極を持つ石英管と水銀/アルゴン雰囲気からなる低圧または中圧のランプである。このような蒸気を介して生成された電気アークは、核酸(260 nm)の最大吸収ピークに近い、低圧ランプでは253.7 nm、中圧ランプでは240-270 nmの光の波長を生成する。この波長はまた大腸菌の最大成長不活化ピーク(268 nm)と一致しており、水銀ランプは優れた殺菌剤、また細菌のUV誘発損傷の研究のための有用なツールになる。
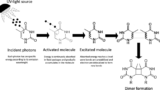
UV-Cの光暴露のゲノムへの効果はさまざまなメカニズムを介して発生する。最も重要なのは、DNA修飾分子に内因性発色団を介して電荷の伝達によって、または窒素性塩基による光子の直接吸収によって、である。直接吸収による主なDNA損傷は、光子が隣接するピリミジンによって強く獲得され、最終的に二量体を形成するものである。二量体化生成物には大きく分けて2種類ある。5–6-cis-syn-cyclobutane (CPD) と pyrimidine-6–4 pyrimidone (6-4PP) の架橋付加体である。ピリミジン二量体化は、ポリメラーゼの正常な滑動を阻害してDNA複製を停止させ、その結果、細胞の複製が停止する(不活化と呼ばれるプロセス)。大腸菌では、チミン-チミン、チミン-シトシン、および/またはシトシン-シトシンの二量体の形成頻度は、それぞれ59%、34%および7%である。しかし、大腸菌の再活性化につながる二量体修復機構には、可視光下でDNAを修復するもの(photoreactivation)から、エラーを起こしやすいSOS系まで、いくつかの自然な機構が存在する。ヌクレオチド除去修復機構(nucleotide excision repair mechanism: NER)は、SOS応答の暗修復とも呼ばれ、紫外線照射によって損傷したdsDNAを主に修復する経路であり、UvrABCエンドヌクレアーゼ多酵素複合体によって駆動される。NERは、2つのUvrAと1つのUvrBサブユニット(A2B)の複合体が、損傷部位を探してDNAをスキャンするときに始まる。その後、UvrAダイマーが放出され、UvrBがUvrCをリクルートし、それが順番に損傷の周りの特定のホスホジエステル結合を加水分解する。UvrD ヘリカーゼはその後、12-13 nt のフラグメントを放出し、ギャップは最終的に DNA ポリメラーゼ Pol I によって満たされる。
このメカニズムは細菌において広範囲に記述されているが、このプロセスは普遍的である。ヒトのNERは、本質的に大腸菌のUvrABCと同じ手順を実行する、はるかに大きな数のタンパク質によって行われ、違いは放出されるDNAフィラメント(27-29 nt)の長さのみである。したがって、発光刺激下での大腸菌培養は、紫外線誘発性DNA損傷の決定、細胞修復能力の観察、そして結果的に細胞の生存および/または死亡挙動の記述のための良いテストシステムである。
最後に、前述の現象のダイナミクスを記述するための様々な側面に対応したいくつかの数学モデルが開発されてきた。ある著者はUV-C光を波のような伝導と考えるが、他の著者はUV-C光を粒子性と考え、光のそれぞれの振る舞いと細胞内部へのダメージの間には顕著な違いがある。例えば、紫外線が細胞マトリックスを伝搬する様子は、波として考えれば連続的なものと考えられるが、紫外線が粒子状の流れとして可視化された場合、DNA塩基は衝撃光子を不連続的に吸収すると考えなければならない。
一方、Chick-Watsonモデルでは、DNAに入射する紫外線の衝撃化学量論、つまり光化学反応を行うには1光子で十分であると考えられている。しかし、これらのモデルは、細胞の不活性化プロセス全体を完全に説明するものではない。代わりに、Adair-Aguiarらは、2つ以上の光子が二量体化反応を引き起こすためにチミン分子の同じ部位にヒットすることが必要である多重衝突速度論を考慮していた。一方、Jagger と Harm は、光反応の結果としてチミン二量体を生成するためには、104 のオーダーの光子数が必要であると考えている。これらの数理モデルの多くは、紫外光の波動・粒子な振る舞いを曖昧に仮定した複雑な記述であり、測定が困難な複数のパラメータを使用しているため、更なる応用には非実用的である。
本研究の目的は、大腸菌におけるUV-C光によるゲノム損傷の生存率と死亡率の速度論を記述し、予測するための2つの単純なモデルを開発することである。実験系としては、大腸菌の成長が早いこと、突然変異やDNA修復機構がよく知られていること、ゲノム構造が詳細に記述されていることを利用して、異なる変異を持つ5つの株を実験系として用いた。我々の数学モデルは、演繹的な性質と機械論的な性質を持っており、どちらも基本的な量子概念に基づいており、その結果は、量子的な死亡率、死亡の最小時間、特異的な死亡速度の3つの主要な変数を介して分析されている。


コメント