Ghodke H, Ho HN, van Oijen AM.
Nat Commun. 2020 Mar 20;11(1):1477.
doi: 10.1038/s41467-020-15179-y. PMID: 32198385; PMCID: PMC7083872.
様々な生命において、染色体DNAに生じた巨大な損傷の認識と修復は、ヌクレオチド除去修復(nucleotide excision repair: NER)因子によって調整されている。すなわち、原核生物のUvrA、真核生物の紫外線DNA損傷結合タンパク質UV-DDB、XPC、XPAおよびそのホモログなどの専用の損傷監視因子が、ゲノムDNAに損傷がないかどうかを常に調査している。これらの損傷認識因子は、DNAが損傷したと思われる場所で、特異的なDNA損傷確認因子(原核生物ではUvrB、真核生物ではTFIIHとその相同遺伝子)を呼び込み、DNAを解きほぐしてヌクレオチドの分解能で損傷の場所を確認する。その後、特殊なエンドヌクレアーゼ(原核生物のUvrCとその同族体、真核生物のXPF-ERCC1/XPGとその同族体)がDNAの部位にリクルートされ、結果的に病変部を含む一本鎖DNA(ssDNA)パッチが切断される。
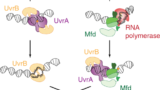
研究対象となったいくつかの生物(一部の古細菌を除く)では、DNA損傷部位でのRNAポリメラーゼ(RNAP)の停止に続いて、鎖特異的なDNA損傷の除去も行われている。この場合、RNAPの三元伸長複合体(ternary elongation complex: TEC)は、新生RNA合成を触媒することができず、超安定的なタンパク質-DNAロードブロックとなる。原核生物のMfd(および真核生物のホモログであるRad26/CSB)をはじめとする専用の転写修復カップリング因子は、これらのTECを再構築し、転写を終了させる。原核生物では、Mfdが続いてUvrA2B複合体を失速部位にリクルートする。同様に、真核生物では、CSBがTFIIH複合体をRNAPIIの失速した部位にリクルートする。失速したTECで引き起こされるDNA修復は、転写結合型修復(transcription-coupled repair: TCR)と呼ばれる。TCRにおける転写鎖からの紫外線誘発損傷の除去率は、非転写DNAからの除去率よりも高い。
UvrAとUvrBの両方が存在する場合、移動するRNAP-Mfd複合体から、停止したRNAP-Mfd-UvrA2、完全なMfd-UvrA2-UvrBハンドオフ複合体まで、多様な中間体がin vitroで容易に形成される。これらの中間体の生理的な意義を明らかにするため、細胞内のMfdを可視化し、TCR反応におけるMfdの寿命を定量化した。蛍光タグ付きのUvrAの細胞内での挙動を調べた最近の研究では、TCRへの関与を検出できなかった。そのため、in vitroの研究にもかかわらず、細胞内でUvrAがTCRをどのように制御しているのかは不明のままである。
本研究では、数百ミリ秒から数分までの幅広いタイムスケールでDNA結合寿命を正確に測定できる高解像度の単一分子イメージング法を適用し、この問題を再検討した。私たちは、「UvrAとMfdおよびUvrBがDNA上で相互作用する時間はどのくらいなのか」という疑問を持った。この疑問に答えるために、蛍光タグを付けたUvrAを可視化し、野生型細胞とTCR欠損細胞でDNAとの相互作用の寿命を測定した。その結果、UvrAはUvrBやMfdが存在しない状態でもDNA上で長寿命であり、その解離は細胞内のUvrBによって促進されることがわかった。UvrBと比較したUvrAの細胞内濃度は、DNAに結合したMfdとの相互作用におけるUvrAの結合寿命に強く影響することがわかった。Mfd-UvrAの結合寿命は、外因性のDNA損傷がない状態でUvrBが制限されている条件下でのみ検出され、UvrBがMfd-UvrAの中間体を乖離する役割を果たしていることが示唆された。紫外線を照射すると、TCR欠損細胞ではUvrAの結合寿命が長くなる。一方、TCR可能な細胞では、UvrAとMfdのDNA結合寿命は同じであり、紫外線照射によって低下することから、TCRではMfd-UvrAの中間体が形成されていると考えられる。これらの結果は、細胞におけるUvrAとMfdの相互作用を特徴づけるものである。以上の通り、私たちは、生体内で複数のパラレルパスウェイに参加しているDNA修復タンパク質の結合動態を、摂動を伴わない1分子イメージング手法を用いて解析するための包括的なフレームワークを確立した。


コメント